Batterij (elektrisch)
Een batterij is een voorwerp dat elektriciteit kan leveren aan draadloze apparaten. Het bestaat uit materialen die zorgen voor een chemische reactie zodat daaruit elektrische energie kan ontstaan. Dit is uitgevonden door Alessandro Volta.
Typen batterijen
Een batterij heeft twee zijden. Een pluspool (+) en een minpool (-). Dit geeft de richting aan waarin de elektriciteit gaat stromen. Wanneer we een batterij aan een apparaat koppelen, dan stroomt de elektriciteit van de minpool door een netwerk van draadjes om bij de pluspool te komen. We kunnen batterijen in twee types verdelen:
- niet oplaadbare batterijen: Na langdurig gebruik raken deze batterijen op. De chemische reacties die zich plaatsvinden kunnen niet teruggedraaid worden, dus zijn ze niet meer op te laden.
- oplaadbare batterijen: Deze batterijen kunnen we wel weer opladen. Hun chemische reactie kan wel teruggedraaid worden door een elektrische stroom op aan te sluiten. Na een zeer langdurig gebruik, verliezen oplaadbare batterijen ook hun kracht.
Batterijen die op zijn leveren we in bij een inleverpunt. Dit zijn bijvoorbeeld winkels en supermarkten die batterijen verkopen. Je mag batterijen niet weggooien in de vuilnisbak. Er kunnen stoffen in zitten die schadelijk zijn voor het milieu. Ook zijn de metalen die erin zitten te hergebruiken.
Batterijen komen voor in verschillende vormen en groottes. Kleine ronde batterijen zitten in horloges, dunne batterijen zitten in telefoons en grote batterijen zitten in auto's. De grootste batterijen zijn te vinden in speciale kamers (in ziekenhuizen of computer data centrums) die ingezet kunnen worden tijdens noodsituaties wanneer de stroom uitvalt.
Geschiedenis
De uitvinding van de batterij, stamt af uit de jaren 200 v.Chr. Mensen hebben overblijfselen van potten gevonden die in staat waren een elektrische lading los te laten. Het idee is door de jaren heen verder ontwikkeld.
In het jaar 1799 heeft Alessandro Volta een betere vorm van zo een pot gemaakt. Deze batterij noemde hij de Zuil van Volta. Daarmee was hij in staat de kracht aan te passen. Deze spanning kunnen we meten en is vernoemd naar Alessandro Volta. Moderne batterijen lijken veel op zijn zuil en hebben een spanning van 1,5 Volt.
Wat zit er in?
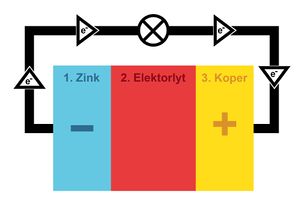
Een batterij bestaat voornamelijk uit 3 onderdelen.
- Zink: De minpool (-) van de batterij bestaat uit zink. Het is een soort metaal dat elektronen loslaat. Dit onderdeel noemen we ook wel de anode.
- Elektrolyt: Het grootste gedeelte van de batterij bestaat uit een speciaal soort gel. Het zorgt voor een chemische reactie. Het bestaat voornamelijk uit zouten en zuren.
- Koper: De pluspool (+) van de batterij bestaat uit koper. Het is een soort metaal dat elektronen ontvangt. Dit onderdeel noemen we ook wel de kathode.
Batterijen kunnen op verschillende manieren worden samengesteld. De combinatie van de bovenstaande onderdelen is afgeleid van de Zuil van Volta.
Hoe werkt het?
Als we de drie onderdelen van een batterij op volgorde aan elkaar vastmaken, dan gaan hun stofjes op elkaar reageren. Het zink laat elektronen los en het koper wil elektronen ontvangen. Dit chemisch proces van loslaten en ontvangen noemen we oxideren en reduceren.
- Oxidatie betekent dat iets elektronen verliest. Het materiaal (zoals zink) verandert van uiterlijk. Je kunt dit het beste zien aan verroest metaal.
- Reductie is het proces waarbij elektronen worden opgenomen.
Zodra een draadje aan de plus en min kant wordt verbonden kan er elektriciteit gaan stromen. Het uitwisselen van elektronen gebeurt razend snel. Zo raakt het zink uitgeput en is onze batterij snel op. Als de batterij aan een lampje wordt verbonden, dan gaat het lampje branden. Het lampje geeft daarbij ook weerstand en kan de elektriciteit minder snel van de pluspool naar de minpool stromen. We kunnen verschillende onderdelen aan deze stroomkring aansluiten om het energieverbruik van een batterij te regelen.
Ieder apparaat heeft een bepaalde hoeveelheid volt nodig. Soms heb je niet genoeg aan één batterij. Door meerdere batterijen aan elkaar te verbinden kunnen we de voltage verhogen.
Videolinks
Externe links
Bronnen
- C. Kersbergen en A. Haarhuis (2011). Natuuronderwijs Inzichtelijk (3e druk). Uitgevrij Couthinho, Bussum.
- Redoxchemie - https://aljevragen.nl/sk/redox.html