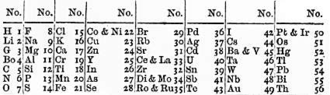
Periodiek systeem
Het Periodiek systeem der elementen is een tabel waarop alle chemische elementen staan. Alle elementen staan niet zomaar in de tabel. Als eerste is de tabel in 7 periodes verdeeld. Deze lopen horizontaal. Ook is de tabel verdeeld in groepen, deze lopen verticaal. Ook wordt de tabel vaak in kleurtjes verdeeld. Hiermee wordt aangegeven dat elementen bij elkaar horen, bijvoorbeeld de Halogenen.
Er zijn 118 elementen. De elementen 119, 120, 121 en 122 komen niet voor op Aarde.
Geschiedenis
Eerste pogingen
Hoewel elementen zoals goud en zilver al eeuwenlang bekend zijn, bestaat het periodiek systeem pas sinds 1869. Maar al voor die tijd werden de eerste pogingen gedaan voor het maken van zo'n systeem. In de prehistorie waren al vrij veel elementen bekend, alleen zag de mens ze toen niet aan voor elementen. De Grieken en Romeinen gaven dit pas echt aan als elementen. Het duurde tot 1669 tot er een nieuw element ontdekt werd, namelijk fosfor door Hennig Brand. De wetenschappelijke revolutie zorgde ervoor dat er allemaal nieuwe elementen ontdekt werden; natuurwetenschap was toen een rage.
In 1817 viel de Duitse scheikundige Johann Dobereiner iets op: de atoommassa van strontium ligt tussen die van calcium en barium. Ook bleken de elementen veel overeenkomsten te hebben. In de jaren erna werd gekeken of dit ook bij andere elementen zo was en er ontstonden allerlei rijtjes. Deze rijtjes bestonden uit drie elementen en werden daarom triades genoemd (tri- betekent drie). Een voorbeeld is de triade lithium, natrium en kalium. De volgorde bij triades is belangrijk; het middelste element is het gemiddelde van de buitenste twee.
Vanaf 1829 werd ook los gekeken van de triades. Er kwamen rijtjes van elementen met dezelfde eigenschappen die uit meer elementen bestonden. Doordat er zoveel verbanden bestonden, wilde men dit in een systeem weergeven. In 1862 deed de Fransman Alexandre-Émile Béguyer de Chancourtois een poging hiertoe; de tellurische helix. Naast elkaar waren de elementen gerangschikt op atoommassa en onder elkaar stonden de elementen met vergelijkbare eigenschappen. Echter kon het systeem maar op een aantal elementen worden toegepast. In 1863 maakte de Britse scheikundige John Alexander Reina Newlands een voorloper van het periodiek systeem. Het bevatte 53 elementen verdeeld in 11 groepen. Veel groepen hadden acht elementen en daarom heette de tabel de wet van octaven (een octaaf is een mooi woord voor acht). Dit wordt ook wel de octetregel genoemd. Veel scheikundigen vonden de wet belachelijk, maar niemand lukte het om de wet onderuit te halen.
Dmitri Mendelejev: de bedenker
In 1869 deed de Rus Dmitri Mendelejev ook een poging, waaruit het periodiek systeem ontstond. Als eerste rangschikte hij de elementen op atoommassa, zodat alle elementen met een (bijna) gelijke atoommassa bij elkaar stonden. Hierna werd gekeken naar andere eigenschappen en hij keek of deze toe of afnamen. Dit zorgde er uiteindelijk voor dat Mendelejev nu als de vader van het periodiek systeem wordt gezien.
Overigens was de Duitser Lothar Meyer op hetzelfde moment bezig met een soortgelijk periodiek systeem. De twee systemen hadden veel overeenkomsten. Mendelejev publiceerde het systeem alleen eerder, waardoor hij als maker wordt gezien en niet Meyer.
Latere ontwikkelingen
Na Mendelejev was het periodiek systeem nog niet af. De reden hiervoor is simpel, in zijn tijd waren er minder elementen bekend. Zo werden gallium, scandium en germanium later ontdekt. Ook bevatte de tabel geen edelgassen. Pas in 1898 plaatste William Ramsey deze er met de toevoeging van argon en verplaatste helium ook naar deze groep. Dankzij de verbeterde apparatuur werden er in de 20e eeuw nog veel meer elementen ontdekt en werden bijna alle gaten opgevuld. Doordat er ook nieuwe relaties ontdekt werden maakte Niels Bohr een nieuwe versie, wat veel lijkt op het huidige. De laatste grote wijziging was in 1940; de lanthaniden en de actiniden staan sindsdien onder de tabel; met dank aan Glenn Seaborg. Door deze twee groepen eronder te zetten, kon het systeem smaller worden gehouden, wat makkelijker was bij het weergeven en afdrukken in boeken (en tegenwoordig op internet).
Aan het einde van de 20e eeuw werd afgesproken om in de hele wereld dezelfde grootheden en cijfers te gebruiken. Voorheen gebruikt men in de Verenigde Staten de Romeinse cijfers, terwijl in de Europa gewone cijfers werden gebruikt. Nog steeds wordt er regelmatig gewijzigd, al gaat het dan om grootheden achter de komma. Ook wordt er soms een nieuw element toegevoegd; die worden vaak in het laboratorium (lab) gemaakt.
Vaak wordt gesuggereerd hoe groot het periodiek systeem kan worden, aangezien er nog steeds nieuwe elementen bij komen. Echter zijn de elementen die de mens maakt erg instabiel en is het logisch dat er weinig van zullen bijkomen.
Uiterlijk
Elk element heeft zijn eigen vakje. In dat vakje staan twee dingen. Als eerste het nummer van het element. Het atoomnummer. Deze lopen van 1 t/m 118. Een paar vakjes hebben haakjes om de nummers heen. Dat betekent dat ze op aarde niet in de natuur voorkomen, maar dat ze in het lab zijn gemaakt. Flerovium en Livermorium zijn gemaakt in het lab, maar komen ook voor in de natuur. Ten tweede komt de scheikundige naam van het element voor op het vakje. Waterstof is bijvoorbeeld H en Zuurstof is O. Niet alle elementen hebben één letter, bijvoorbeeld IJzer (Fe). De tweede letter is altijd een kleine letter.
Vakjes: De elementen
Het periodiek systeem der elementen telt in totaal 118 vakjes. Elk vakje heeft doorgaans twee gegevens. Als eerste staat het nummer vermeld. In de scheikunde wordt dat het atoomnummer genoemd. Daaronder staat de scheikundige afkorting van het element.
Wat is een element nou eigenlijk? Een element is simpelweg een soort atoom. Elke stof die er bestaat, is opgebouwd uit moleculen, die op hun beurt bestaan uit atomen. Een molecuul is de kleinste hoeveelheid van een stof die nog alle eigenschappen van die stof heeft. Door moleculen te onderzoeken kunnen we ze een afkorting (een structuurformule) geven. Bij water is dit bijvoorbeeld H2O. Elk atoom dat er bestaat heeft een eigen letter of twee eigen letters. Hierdoor weten we dat een watermolecuul bestaat uit twee keer een H (dus 2x waterstof) en 1 keer een O (dus 1x zuurstof). In totaal zijn er 118 soorten atomen, die allemaal een andere letter of lettercombinatie hebben. Aangezien het alfabet maar uit 26 letters bestaat, hebben sommige atomen twee letters gekregen. Zo is de afkorting van Magnesium Mg. De eerste letter is dan met een hoofdletter en de tweede een kleine letter. Anders kan men denken dat de G weer voor ander atoom staat. De woorden atoom en chemisch element kunnen dus door elkaar worden gebruikt. Het enige verschil is dat met "element" de soort atoom wordt bedoeld en met "atoom" de atoom zelf. Hierdoor houdt men in dit geval liever chemisch element aan. Men gebruikt afkortingen aangezien dit internationaal handiger werkt. De afkortingen komen meestal van de Griekse of Latijnse benaming van het element.
Wat betekent het atoomnummer dan precies? Elk atoom heeft in de kern twee soorten deeltjes zitten. Een van die soort deeltjes heten protonen. En de andere soort zijn de neutronen. Elk element heeft een ander aantal protonen. Een waterstofatoom heeft 1 proton, natrium heeft er 11 en goud heeft 79 protonen. Aan het aantal protonen kan men ook zien welk element het atoom is dat men onderzoekt. Dit aantal protonen wordt het atoomnummer genoemd. Deze staat in het periodiek systeem zodat men tijdens het onderzoek snel kan zien, zonder na te denken, welk element het atoom is. Onthoud wel dat hoe hoger het aantal protonen, hoe instabieler een element is. Instabieler wil zeggen dat een element in een ander element kan veranderen (verval heet dat).
Alleen de eerste 94 elementen komen dan ook voor in de natuur, waarvan er ook instabiele tussen zitten zoals uranium. De laatste elementen zijn gemaakt in laboratoria. Vaak worden zij aangegeven door het atoomnummer tussen haakjes te zetten. Dat maken gebeurt door kernfusie. Fusie betekent samensmelten. Hierbij wordt een groter atoom beschoten met een kleiner atoom door middel van een apparaat dat een cyclotron of deeltjesversneller heet.
Kernfusie gebeurt ook in de sterren en dus ook in onze zon.
Kolommen: groepen

In het periodiek systeem staan de elementen niet zo maar. Ze zijn verdeeld volgens drie bepaalde systemen. De eerste van deze systemen zijn groepen en families. Deze groepen volgen grotendeels de verticale rijen (de kolommen).
Op deze twee groepen na wordt iedere groep naar het eerste element in de kolom vernoemd. Zo heet kolom 6 de chroomgroep, aangezien chroom het eerste element is dat in die kolom voorkomt. Bij kolom 1 moet men wel oppassen. Die heet niet de waterstofgroep, maar de lithiumgroep. Waterstof wordt namelijk niet bij de groepen gerekend. Kolom 1 en 2 hebben ook nog een andere naam. Kolom 1 mag ook de alkalimetalen genoemd worden en kolom 2 mag naast Berylliumgroep ook aardalkalimetalen genoemd worden. Ook mag je kolom 17 naast fluorgroep het ook halogenen noemen en kolom 18 mag naast heliumgroep of neongroep ook edelgassen genoemd worden. In principe zijn deze namen verouderd, maar ze worden soms nog weleens gebruikt. Leuk weetje is dat kolom 8, 9 en 10 vroeger als 1 groep gezien werden. De lanthaniden en de actiniden (de twee rijen onderaan het periodiek systeem) vallen onder de scandiumgroep.
Elementen worden ingedeeld op basis van een aantal kenmerken die ze gemeen hebben. Naarmate je meer naar onder gaat worden deze kenmerken steeds duidelijker, steeds meer aanwezig. Waterstof wordt niet in één van de groepen ingedeeld, aangezien waterstof met geen enkel ander element kenmerken deelt. Men heeft het slechts om ruimte te besparen bovenaan de lithiumgroep gezet.
Rijen: Periodes

De horizontale rijen heten de periodes. Het periodiek systeem is ook naar de periodes vernoemd. In totaal zijn er 7 periodes (rijen)
Wat zijn periodes nou precies? Als eerste gaan we daarvoor terug naar de basis. Een atoom heeft naast protonen ook elektronen. Elektronen zitten niet in de kern, maar cirkelen om de kern heen (wordt ook elektronenwolk genoemd). Je kunt het eigenlijk een beetje vergelijken als ons zonnestelsel. Een kern (de zon) met daarom heen elektronen (de planeten). Net als in ons zonnestelsel heb je bij een atoom elektronen die dichtbij de kern blijven en elektronen die ver van de kern verwijderd zijn. Ook dit verschilt per element. Je kunt om de kern denkbeeldige lijnen trekken. Elke lijn vormt een soort schil om de kern heen (de elektronenschil). Een atoom kan er maximaal 7 hebben. Periodes geven eigenlijk aan hoeveel van deze schillen zijn opgevuld met elektronen. Zwavel staat bijvoorbeeld in periode 3, wat betekent dat het element drie schillen heeft die elk elektronen bevatten. Aangezien elektronen altijd het liefst dicht bij de kern blijven, worden eerst de binnenste lagen/schillen gevuld tot die helemaal vol zijn. Bij zwavel zijn de eerste twee schillen dus helemaal gevuld. Of de derde schil vol is kun je niet zo aflezen, daarvoor zal je het atoom van dichtbij moeten bekijken. Wel kun je met zekerheid zeggen dat er in de derde schil elektronen voorkomen.
Kleuren: reeksen
De kleuren van de vakjes geven aan tot welke reeks het element behoort. Deze elementen hebben dezelfde scheikundige en natuurkundige eigenschappen. Maar er zijn wel kleinere verschillen te zien. Vaak is dit zo geplaatst dat het oploopt, alleen de manier waarop verschilt. Zo kan dit verticaal, horizontaal of diagonaal zijn. In totaal zijn er 10 verschillende reeksen.
Het Systeem
Het huidige periodiek systeem
Hieronder zie je een weergave van het systeem. Een paar vakjes hebben haakjes om de atoomnummers heen. Dat betekent dat ze op aarde niet in de natuur voorkomen, maar dat ze in het laboratorium zijn gemaakt:
| 1 Ia |
18 0 | ||||||||||||||||||
| 1 | 1 H |
2 IIa |
13 IIIa |
14 IVa |
15 Va |
16 VIa |
17 VIIa |
2 He | |||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||
| 3 | 11 Na |
12 Mg |
3 IIIb |
4 IVb |
5 Vb |
6 VIb |
7 VIIb |
8 VIIIb |
9 VIIIb |
10 VIIIb |
11 Ib |
12 IIb |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
(43) Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 Fr |
88 Ra |
** |
(104) Rf |
(105) Db |
(106) Sg |
(107) Bh |
(108) Hs |
(109) Mt |
(110) Ds |
(111) Rg |
(112) Cn |
(113) Nh |
(114) Fl |
(115) Mc |
(116) Lv |
(117) Ts |
(118) Og |
|
| *Lanthaniden | 57 La |
58 Ce |
59 Pr |
60 Nd |
(61) Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||
| **Actiniden | 89 Ac |
90 Th |
91 Pa |
92 U |
(93) Np |
(94) Pu |
(95) Am |
(96) Cm |
(97) Bk |
(98) Cf |
(99) Es |
(100) Fm |
(101) Md |
(102) No |
(103) Lr | ||||
| Alkalimetalen | Aardalkalimetalen | Overgangsmetalen | Hoofdgroepmetalen | Metalloïden |
| Niet-metalen | Halogenen | Edelgassen | Lanthaniden | Actiniden |
Alternatieven
In de circa 100 jaar dat het Periodiek Systeem bestaat zijn er meer dan 700 versies van gemaakt. Vooral de vorm wordt steeds aangepast. Zo zijn er verschillende maten rechthoeken gemaakt, maar ook is het periodiek systeem afgebeeld als cirkel, kubus, cilinder, spiraal, driehoek of piramide. De reden hiervoor is dat deze vormen elk bepaalde scheikundige of natuurkundige eigenschappen van de elementen laten zien.
De bekendste maat is het rechthoekige periodiek systeem met 32 kolommen in plaats van 18 kolommen. In principe is deze iets preciezer, maar voor het systeem zelf is dat te breed om af te drukken in boeken. Hierdoor blijft de normaal periodiek systeem het meest gebruikt.