Koolstof: verschil tussen versies
(Verwijderd op Commons en gecontroleerd.) |
|||
| (32 tussenliggende versies door 4 gebruikers niet weergegeven) | |||
| Regel 1: | Regel 1: | ||
| + | {{Info Chemisch element |
||
| − | [[Bestand:Coal_anthracite.jpg|thumb|250px|Een stukje koolstof]] |
||
| + | | afbeelding = Coal_anthracite.jpg |
||
| ⚫ | |||
| + | | ander formaat = |
||
| + | | bijschrift = Een stukje antraciet |
||
| + | | naam = Koolstof / Carbonium ([[Latijn]]) |
||
| + | | latijn = |
||
| + | | symbool = C |
||
| + | | atoomnummer = 6 |
||
| + | | soort = niet-metaal |
||
| + | | kleur = zwart |
||
| + | | smeltpunt = 3652 <!-- Smeltpunt in celsius --> |
||
| + | | kookpunt = 4827 <!-- Kookpunt in celsius --> |
||
| + | }} |
||
| + | '''Koolstof''' (van het Latijn : ''carbo'' "kool") is een scheikundig element met het symbool '''C''' en [[atoomnummer]] 6. Het is niet-metaalachtig. Het behoort tot groep 14 van het [[Periodiek systeem|periodiek systeem]]. Koolstof in zijn natuurlijke vorm, vormt slechts ongeveer 0,025 procent van de [[aardkorst]]. Koolstof is een van de weinige elementen die sinds de [[oudheid]] bekend zijn. |
||
== Voorkomen == |
== Voorkomen == |
||
| ⚫ | |||
| − | Koolstof komt op heel veel plekken voor, zoals in [[pindakaas]] en in [[planten]] maar ook in bijvoorbeeld [[diamant]]. Diamant ontstaat als je koolstof heel erg samendrukt. Koolstof zit ook veel in [[benzine]]. |
||
| + | |||
| + | Koolstof is het 15e meest voorkomende element in de [[aardkorst]], en het vierde meest voorkomende element in het [[universum]] in massa na [[Waterstof (element)|waterstof]], [[helium]] en [[Zuurstof (element)|zuurstof]]. De overvloed aan koolstof, met een enorme variatie aan organische verbindingen (koolwaterstoffen) en het ongebruikelijke vermogen om ''polymeren'' te vormen bij de temperaturen die gewoonlijk op aarde worden aangetroffen. ''Polymeren'' zijn stoffen of materialen zoals [[Plastic|plastics]] en kunstmatig rubber die bestaan uit zeer grote [[Molecuul|moleculen]] of macromoleculen. De (natuurlijke) polymeren met meerdere atomen koolstof komen in allerlei vormen voor in al het bekende leven (planten en dieren). Het is dan ook het tweede meest voorkomende element in het [[Menselijk lichaam|menselijk lichaam]] in massa (ongeveer 18,5%) na [[Zuurstof (element)|zuurstof]]. |
||
| + | |||
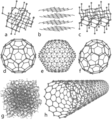
| + | De [[atomen]] van koolstof kunnen op verschillende manieren aan elkaar binden, de zogeheten ''allotropen''. Bekende ''allotropen'' zijn [[grafiet]] (zit in potlood), [[diamant]], steenkool en ''fullerenen'' (ingewikkelde kippengaasachtige atoomstructuren - zie modellen). Het voorkomen van koolstof kan sterk van vorm, kleur en hardheid variëren. Grafiet is bijvoorbeeld ondoorzichtig en zwart, terwijl diamant zeer ''transparant'' (doorzichtig) is. Grafiet is zacht genoeg om een streep op papier te vormen (vandaar de naam, van het Griekse werkwoord "γράφειν", ''gráfein'' wat "schrijven" betekent), terwijl diamant het moeilijkste bewerkbare natuurlijk voorkomende materiaal is dat bekend is. Grafiet is een goede elektrische geleider terwijl diamant stroom slecht door laat. Onder normale omstandigheden hebben diamant, koolstofnanobuisjes en grafeen de hoogste warmte geleiding van alle bekende materialen. Alle koolstof-allotropen zijn onder normale omstandigheden vaste stoffen. Koolstof-allotropen zijn bestand tegen chemische inwerking en hebben een hoge temperatuur nodig om zelfs met zuurstof te reageren. |
||
| + | |||
| + | Een verbinding tussen koolstof en zuurstof komt in twee gasvormen voor: Koolmonoxide (giftig en verstikkend) en kooldioxide (zit in de adem die je uitademt). Niet-organische koolstof bronnen zijn ''kalksteen'', ''dolomieten'' en kool(stof)dioxide, maar aanzienlijke hoeveelheden komen voor in organische afzettingen van [[steenkool]], [[turf]] en [[olie]]. Koolstof vormt een groot aantal verbindingen, meer dan enig ander [[Chemisch element|chemisch element]], met bijna tien miljoen verbindingen die tot nu toe zijn beschreven. Een toch is dat aantal maar een heel klein deel van het aantal mogelijke verbindingen wat theoretisch onder standaardomstandigheden te maken zou zijn of zou voorkomen. Om deze reden wordt koolstof vaak de "koning van de elementen" genoemd. |
||
| + | |||
| + | == Koolstof als erts of mineraal en organische afzetting == |
||
| + | <gallery> |
||
| + | Bestand:Glassy carbon and a 1cm3 graphite cube HP68-79.jpg|Glasachtig koolstof en een grafietblokje van 1 cm<sup>3</sup> ter vergelijking. |
||
| + | Bestand:Carbon (6 C).jpg|Stuk koolstof |
||
| + | Bestand:Charcoal 9.jpg|Houtskool |
||
| + | Bestand:Fossil charcoal in weathered coal (Bedford Coal, Middle Pennsylvanian; Noland Tunnel's north portal outcrop, Tunnel Hill, Coshocton County, Ohio, USA) 9 (31789395721).jpg|Fossiele houtskool |
||
| + | Bestand:Steenkool - G43OFL - 60007535 - RCE.jpg|Steenkool |
||
| + | Bestand:Peat bank, Sothers Field - geograph.org.uk - 1866827.jpg|Deels gestoken turf |
||
| + | Bestand:Pagin 2020-03-08 14.jpg|Plas aardolie |
||
| + | Bestand:GraphiteOreUSGOV.jpg|Grafieterts |
||
| + | Bestand:Rough diamond.jpg|Ruwe diamant |
||
| + | Bestand:Interieur, detail van wand met marmer in de hal op de eerste verdieping - Rotterdam - 20535034 - RCE.jpg|'''Marmer''' is een ''metamorf gesteente'' dat bestaat uit herkristalliseerde carbonaatmineralen, meestal ''calciet'' of ''dolomiet'' |
||
| + | Bestand:Calcite-20188.jpg|Calcietbloem met calciumcarbonaat. |
||
| + | Bestand:Dolomite Luzenac.jpg|Dolomiet op talkgesteente |
||
| + | </gallery> |
||
| + | |||
| + | == Modellen van koolstof en koolstofverbindingen == |
||
| + | <gallery> |
||
| + | Bestand:Carbon-dioxide-3D-vdW.svg|Koolstofdioxine [[molecuul]] (CO<sub>2</sub>) met 1 koolstof [[atoom]] (C, zwart) en 2 zuurstof atomen (O, rood). Ook bekend als koolzuurgas of prik in limonade |
||
| + | Bestand:Carbonic-acid-3D-balls.png|Koolzuur (H<sub>2</sub>CO<sub>3</sub>), of (di)waterstofcarbonaat. Wordt gebruikt in bruistabletten voor het oplossen van geneesmiddelen, vitamines, etc. |
||
| + | Bestand:Carbon monoxide 3d model 2.png|Koolmonoxide (CO) |
||
| + | Bestand:Eight Allotropes of Carbon.png|Acht voorbeelden van allotropen van koolstof: a) Diamant, b) Grafiet, c) Lonsdaleiet, d) C60 (Buckminsterfullereen), e) C540 (Fullereen), f) C70 (Fullereen), g) Amorfe koolstof (b.v. houtskool), h) enkelwandige koolstof nanobuis |
||
| + | Bestand:Beta-D-glucose-3D-vdW.png|Glucose (C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>), bevat 6 koolstof- (C), 12 waterstof- (H) en 6 zuurstofatomen (O). Het is een soort suiker. |
||
| + | Bestand:Fructose-3D-balls.png|Fructose (C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>), soort suiker |
||
| + | Bestand:Syndiotactic polypropene.png|Kunststof, polymeer (paarsblauw is hier koolstof) |
||
| + | Bestand:Cholecalciferol-vitamin-D3-from-xtal-3D-sticks.png|Vitamine D3 (C<sub>27</sub>H<sub>44</sub>O), is onder andere belangrijk voor de ontwikkeling van de botten. |
||
| + | </gallery> |
||
| + | |||
| + | == Gebruik == |
||
| + | Koolstof komt op heel veel plekken voor, zoals in koolwaterstoffen ([[steenkool]], [[aardolie]] en [[aardgas]]), maar ook in bijvoorbeeld [[diamant]]. Diamant ontstaat als je koolstof heel erg samendrukt. Koolstof zit ook veel in [[benzine]], wat gemaakt is uit aardolie. Naast benzine (voor auto's) worden er nog andere zogeheten fossiele brandstoffen uit aardolie gehaald, zoals [[petrolium]], [[diesel]] en [[kerosine]] (voor vliegtuigen). Hout en kolen zijn ook fossiele brandstoffen. Bij al deze stoffen komt er bij (volledige) verbranding kooldioxide (CO<sub>2</sub>) en water vrij. Kooldioxide is mede de oorzaak van [[luchtvervuiling]]. Doordat er steeds meer van dit gas in de lucht komt is het een van de oorzaken van de opwarming van de aarde ([[broeikaseffect]]). |
||
| + | |||
| + | Bij een slechte of onvolledige verbranding kan er koolmonoxide ontstaan. Dit gas is giftig, verstikkend en dus dodelijk. Dit gebeurd wel eens bij vervuilde gasbranders of geisers. Bij het koken is het goed ventileren dan ook verstandig. Brand- en/of koolmonoxide melders worden door de brandweer geadviseerd. |
||
| + | |||
| + | Daarnaast worden uit aardolie stoffen gehaald zoals ''bitumen'' voor het [[asfalt]] waar wegen van worden gemaakt. |
||
| + | |||
| + | Plastics (kunststoffen) zijn hierboven al genoemd. Kunststoffen hebben als nadeel dat het als zwerfafval in de rivieren en oceanen terecht kunnen komen en daar verbrokkelen en de [[plasticsoep]] in de oceanen veroorzaken. |
||
| + | |||
| + | Er worden ook Vezelversterkte kunststoffen gemaakt die carbon heten. Deze worden bijvoorbeeld gebruikt voor frames van racefietsen en tennisrackets. Dit materiaal is lastig her te gebruiken ([[recycling]]). |
||
| + | |||
| + | Drukinkt (vooral zwart) bevat ook koolstof, deels als kleurstof. Het vet in de inkt bevat trouwens ook koolstof. Smeer je drukinkt op een heel dun papier, dan krijg je carbonpapier, waarmee je tekeningen kunt overzetten op bijvoorbeeld blank hout. |
||
| + | === Biologie === |
||
| + | Koolstof komt ook voor in plantaardige stoffen zoals in [[pindakaas]] en slaolie. Veel van wat we dagelijks eten en drinken bevat koolstof. Denk aan aardappelen, groenten en fruit, maar ook brood. Laat je dit aanbakken dan zie je een zwart laagje koolstof ontstaan. [[Suikers]] (zoals ''glucose, fructose en sacherose'') en zetmeel ([[Frisdrank|frisdranken]], [[snoep]], zoet beleg, [[brood]], [[Pasta (deegwaar)|pasta]] en [[rijst]]) bevatten koolstof in de vorm van [[Koolhydraat|koolhydraten]]. Kauw maar eens wat langer op een korstje brood, dan proef je dat het zoeter wordt. Het speeksel in je mond zet het [[zetmeel]] dan om in suikers . Ook vetten en eiwitten bevatten koolstof. Verderop in je lichaam ([[maag]] en [[darmen]]) wordt het voedsel verbrand, alleen gaat dat niet met vuur. Zo krijg je wel energie in je lijf om te kunnen bewegen. |
||
| + | |||
| + | [[Vitamine|Vitamines]] worden ook gevormd door koolstof-, zuurstof- en waterstofatomen. Vitamines zijn voedingsstoffen. Ze komen in kleine hoeveelheden voor in eten en drinken. Ze zijn nodig voor een normale ontwikkeling en groei en zijn nodig om gezond te blijven. Ze leveren geen energie. |
||
| + | |||
| + | Het mooie van groene planten en bomen is, dat ze kooldioxide uit de [[lucht]] halen en er [[Zuurstof (element)|zuurstof]] voor teruggeven. Dit proces gebeurt in het [[Bladgroenkorrel|bladgroen]] van de [[plant]] en bladeren van [[bomen]]. Het proces heet [[fotosynthese]]. Probleem is echter dat de planten en bomen het teveel aan kooldioxide in de lucht niet (meer) allemaal omgezet krijgen (het natuurlijke evenwicht is verstoord). Als er dan ook nog veel bossen worden gekapt, wordt het probleem alleen maar groter. |
||
| + | |||
| + | == Veiligheid == |
||
| + | <gallery> |
||
| + | Bestand:GHS-pictogram-flamme.svg|Houtskool en aardolieproducten, plastics etc Zijn brandbaar |
||
| + | Bestand:GHS-pictogram-pollu.svg|De niet of moeilijk afbreekbare koolstof verbindingen zijn slecht voor het milieu |
||
| + | Bestand:GHS-pictogram-skull.svg|Met name koolmonoxide is giftig en verstikkend |
||
| + | Bestand:GHS-pictogram-explos.svg|Koolstof verwerkt in kruit is explosief |
||
| + | Bestand:GHS-pictogram-silhouette.svg|Sommige koolstof verbindingen zijn gevaarlijk bij inademing en inname |
||
| + | </gallery> |
||
| + | |||
| + | == Toepassingen == |
||
| + | <gallery> |
||
| + | Bestand:Diamond.jpg|Geslepen diamant op goeden ring |
||
| + | Bestand:Grafietpotloden.jpg|Grafietpotloden |
||
| + | Bestand:Kohlenstofffasermatte.jpg|Versterkte koolstofvezel of carbon |
||
| + | Bestand:Carbon paper.jpg|Carbonpapier |
||
| + | Bestand:Barbecue griglia 02.jpg|Houtskool voor de barbecue |
||
| + | Bestand:Tanke.JPG|Tankstation voor benzine, diesel, autogas en dergelijke |
||
| + | Bestand:Inks and additives in a lithographic printing studio.jpg|Drukinkten |
||
| + | Bestand:Wheat products.jpg|Graanproducten |
||
| + | Bestand:Plastic household items.jpg|Allerlei kunststof (plastic) voorwerpen |
||
| + | </gallery> |
||
| + | |||
| + | == Plaats in het Periodiek systeem == |
||
{{periodiek systeem}} |
{{periodiek systeem}} |
||
| + | {{User:Rots61/Veelbekeken/Beg}} |
||
| − | {{beginnetje}} |
||
| − | [[Categorie: |
+ | [[Categorie:Chemische elementen]] |
| + | [[Categorie:Scheikunde]] |
||
Huidige versie van 3 jan 2023 om 20:17
| Chemisch element | |

| |
| Een stukje antraciet | |
| Naam | Koolstof / Carbonium (Latijn) |
| Symbool | C |
| Atoomnummer | 6 |
| Soort | niet-metaal |
| Kleur | zwart |
| Smeltpunt | 3652 oC |
| Kookpunt | 4827 oC |
| Portaal | |
|---|---|
Koolstof (van het Latijn : carbo "kool") is een scheikundig element met het symbool C en atoomnummer 6. Het is niet-metaalachtig. Het behoort tot groep 14 van het periodiek systeem. Koolstof in zijn natuurlijke vorm, vormt slechts ongeveer 0,025 procent van de aardkorst. Koolstof is een van de weinige elementen die sinds de oudheid bekend zijn.
Voorkomen
In de natuur kan koolstof onder anderen voorkomen in de vorm van diamant, grafiet en normale koolstof. Koolstof is wat overblijft nadat je hout verbrandt.
Koolstof is het 15e meest voorkomende element in de aardkorst, en het vierde meest voorkomende element in het universum in massa na waterstof, helium en zuurstof. De overvloed aan koolstof, met een enorme variatie aan organische verbindingen (koolwaterstoffen) en het ongebruikelijke vermogen om polymeren te vormen bij de temperaturen die gewoonlijk op aarde worden aangetroffen. Polymeren zijn stoffen of materialen zoals plastics en kunstmatig rubber die bestaan uit zeer grote moleculen of macromoleculen. De (natuurlijke) polymeren met meerdere atomen koolstof komen in allerlei vormen voor in al het bekende leven (planten en dieren). Het is dan ook het tweede meest voorkomende element in het menselijk lichaam in massa (ongeveer 18,5%) na zuurstof.
De atomen van koolstof kunnen op verschillende manieren aan elkaar binden, de zogeheten allotropen. Bekende allotropen zijn grafiet (zit in potlood), diamant, steenkool en fullerenen (ingewikkelde kippengaasachtige atoomstructuren - zie modellen). Het voorkomen van koolstof kan sterk van vorm, kleur en hardheid variëren. Grafiet is bijvoorbeeld ondoorzichtig en zwart, terwijl diamant zeer transparant (doorzichtig) is. Grafiet is zacht genoeg om een streep op papier te vormen (vandaar de naam, van het Griekse werkwoord "γράφειν", gráfein wat "schrijven" betekent), terwijl diamant het moeilijkste bewerkbare natuurlijk voorkomende materiaal is dat bekend is. Grafiet is een goede elektrische geleider terwijl diamant stroom slecht door laat. Onder normale omstandigheden hebben diamant, koolstofnanobuisjes en grafeen de hoogste warmte geleiding van alle bekende materialen. Alle koolstof-allotropen zijn onder normale omstandigheden vaste stoffen. Koolstof-allotropen zijn bestand tegen chemische inwerking en hebben een hoge temperatuur nodig om zelfs met zuurstof te reageren.
Een verbinding tussen koolstof en zuurstof komt in twee gasvormen voor: Koolmonoxide (giftig en verstikkend) en kooldioxide (zit in de adem die je uitademt). Niet-organische koolstof bronnen zijn kalksteen, dolomieten en kool(stof)dioxide, maar aanzienlijke hoeveelheden komen voor in organische afzettingen van steenkool, turf en olie. Koolstof vormt een groot aantal verbindingen, meer dan enig ander chemisch element, met bijna tien miljoen verbindingen die tot nu toe zijn beschreven. Een toch is dat aantal maar een heel klein deel van het aantal mogelijke verbindingen wat theoretisch onder standaardomstandigheden te maken zou zijn of zou voorkomen. Om deze reden wordt koolstof vaak de "koning van de elementen" genoemd.
Koolstof als erts of mineraal en organische afzetting
Modellen van koolstof en koolstofverbindingen
Gebruik
Koolstof komt op heel veel plekken voor, zoals in koolwaterstoffen (steenkool, aardolie en aardgas), maar ook in bijvoorbeeld diamant. Diamant ontstaat als je koolstof heel erg samendrukt. Koolstof zit ook veel in benzine, wat gemaakt is uit aardolie. Naast benzine (voor auto's) worden er nog andere zogeheten fossiele brandstoffen uit aardolie gehaald, zoals petrolium, diesel en kerosine (voor vliegtuigen). Hout en kolen zijn ook fossiele brandstoffen. Bij al deze stoffen komt er bij (volledige) verbranding kooldioxide (CO2) en water vrij. Kooldioxide is mede de oorzaak van luchtvervuiling. Doordat er steeds meer van dit gas in de lucht komt is het een van de oorzaken van de opwarming van de aarde (broeikaseffect).
Bij een slechte of onvolledige verbranding kan er koolmonoxide ontstaan. Dit gas is giftig, verstikkend en dus dodelijk. Dit gebeurd wel eens bij vervuilde gasbranders of geisers. Bij het koken is het goed ventileren dan ook verstandig. Brand- en/of koolmonoxide melders worden door de brandweer geadviseerd.
Daarnaast worden uit aardolie stoffen gehaald zoals bitumen voor het asfalt waar wegen van worden gemaakt.
Plastics (kunststoffen) zijn hierboven al genoemd. Kunststoffen hebben als nadeel dat het als zwerfafval in de rivieren en oceanen terecht kunnen komen en daar verbrokkelen en de plasticsoep in de oceanen veroorzaken.
Er worden ook Vezelversterkte kunststoffen gemaakt die carbon heten. Deze worden bijvoorbeeld gebruikt voor frames van racefietsen en tennisrackets. Dit materiaal is lastig her te gebruiken (recycling).
Drukinkt (vooral zwart) bevat ook koolstof, deels als kleurstof. Het vet in de inkt bevat trouwens ook koolstof. Smeer je drukinkt op een heel dun papier, dan krijg je carbonpapier, waarmee je tekeningen kunt overzetten op bijvoorbeeld blank hout.
Biologie
Koolstof komt ook voor in plantaardige stoffen zoals in pindakaas en slaolie. Veel van wat we dagelijks eten en drinken bevat koolstof. Denk aan aardappelen, groenten en fruit, maar ook brood. Laat je dit aanbakken dan zie je een zwart laagje koolstof ontstaan. Suikers (zoals glucose, fructose en sacherose) en zetmeel (frisdranken, snoep, zoet beleg, brood, pasta en rijst) bevatten koolstof in de vorm van koolhydraten. Kauw maar eens wat langer op een korstje brood, dan proef je dat het zoeter wordt. Het speeksel in je mond zet het zetmeel dan om in suikers . Ook vetten en eiwitten bevatten koolstof. Verderop in je lichaam (maag en darmen) wordt het voedsel verbrand, alleen gaat dat niet met vuur. Zo krijg je wel energie in je lijf om te kunnen bewegen.
Vitamines worden ook gevormd door koolstof-, zuurstof- en waterstofatomen. Vitamines zijn voedingsstoffen. Ze komen in kleine hoeveelheden voor in eten en drinken. Ze zijn nodig voor een normale ontwikkeling en groei en zijn nodig om gezond te blijven. Ze leveren geen energie.
Het mooie van groene planten en bomen is, dat ze kooldioxide uit de lucht halen en er zuurstof voor teruggeven. Dit proces gebeurt in het bladgroen van de plant en bladeren van bomen. Het proces heet fotosynthese. Probleem is echter dat de planten en bomen het teveel aan kooldioxide in de lucht niet (meer) allemaal omgezet krijgen (het natuurlijke evenwicht is verstoord). Als er dan ook nog veel bossen worden gekapt, wordt het probleem alleen maar groter.
Veiligheid
Toepassingen
Plaats in het Periodiek systeem
| Periodiek systeem | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||